- Suv max накопление таблица расшифровки онкология
- Вопрос №2. Что такое радиофармпрепарат?
- Вопрос №3. Что такое физиологическое накопление РФП?
- Вопрос №4. Что такое патологическое накопление РФП?
- Вопрос №5. Что такое метаболически активное и метаболически неактивное образование?
- Вопрос №6. Что такое SUV?
- Вопрос №7. Для чего используется величина SUV?
- Suv max накопление таблица расшифровки онкология
Suv max накопление таблица расшифровки онкология
Исследование «всего тела» заключается в сканировании пациента от уха до верхней трети бедра. Т.е. в область исследования будут включены голова (частично, от козелка уха, без захвата головного мозга), шея, органы грудной полости, брюшной полости, малого таза и костная система (без верхних и нижних конечностей).
Сканирование нижних конечностей проводится за дополнительную плату.
Вопрос №2. Что такое радиофармпрепарат?
Радиофармпрепарат (РФП) – это соединение, состоящее из специального вещества и радионуклида (изотопа, радионуклидной метки). Специальное вещество отвечает за то, в каком органе накопится РФП, а радионуклидная метка позволяет врачу-диагносту увидеть это накопление на изображении.
В настоящее время для производства РФП используется очень широкий спектр как специальных веществ, так и радионуклидных меток. Во всем мире самым часто используемым у онкологических больных соединением специального вещества и радионуклидной метки является 18 F-фтордезоксиглюкоза ( 18 F-ФДГ). В данном соединении 18 F выполняет функцию радионуклидной метки, ФДГ – специального вещества.
Вопрос №3. Что такое физиологическое накопление РФП?
Физиологическое накопление (гиперфиксация) РФП – это повышенное накопление РФП, определяющееся в различных органах и системах в норме.
Физиологическое накопление наблюдается при исследованиях со всеми РФП: 18 F-ФДГ, 11 С-холином, 11 С-метионином, 68 Ga-ПСМА и т.д. В зависимости от типа РФП меняется лишь местоположение физиологической гиперфиксации. Например, при ПЭТ и ПЭТ/КТ с самой часто используемой 18 F-ФДГ физиологическое накопление РФП определяется в коре головного мозга, ротоглотке, носоглотке, мышцах гортаноглотки, миокарде левого желудочка, чашечно-лоханочных системах почек, фрагментарно по ходу петель толстой кишки, мочевом пузыре.
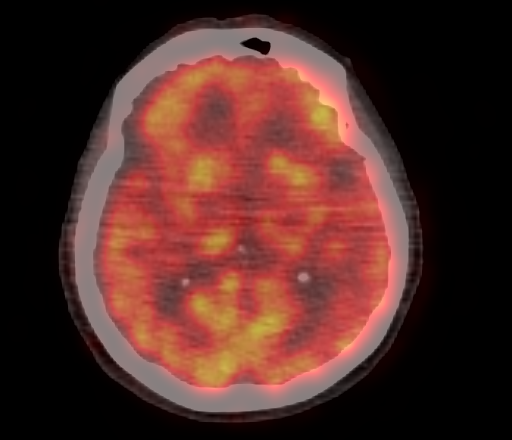 |  |
| Физиологическое накопление 18 F-ФДГ в коре головного мозга. | |
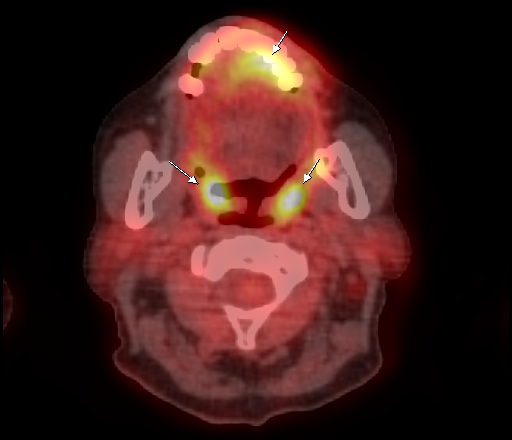 |  |
| Физиологическое накопление 18 F-ФДГ в ротоглотке. | |
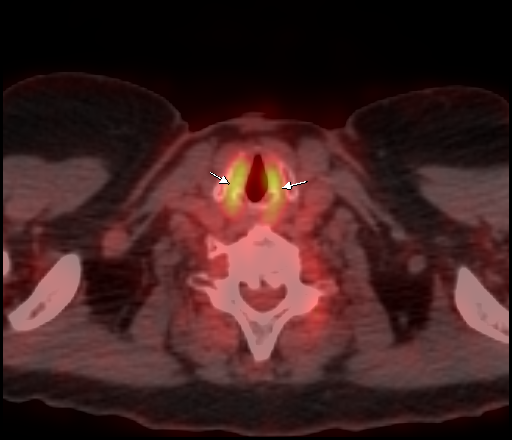 |  |
| Физиологическое накопление 18 F-ФДГ в мышцах гортаноглотки. | |
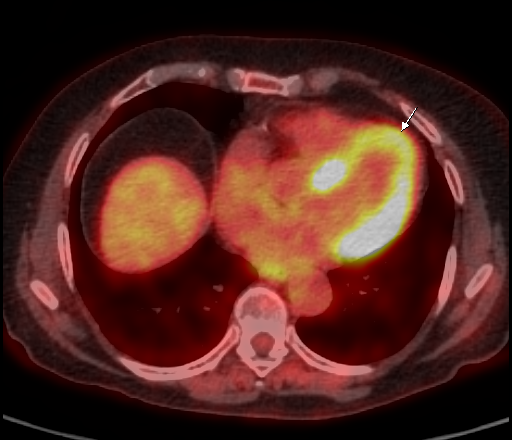 |  |
| Физиологическое накопление 18 F-ФДГ в миокарде левого желудочка. | |
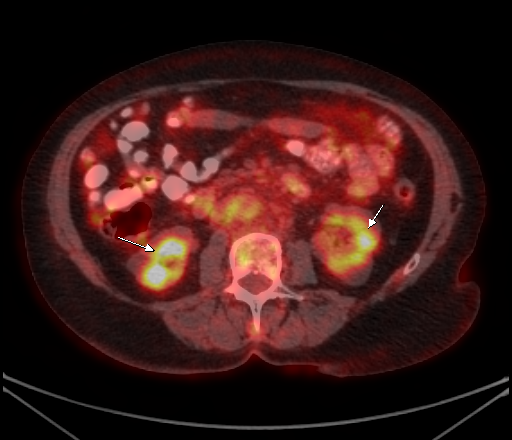 | 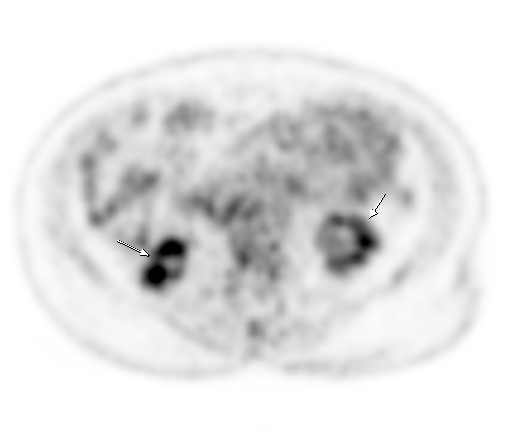 |
| Физиологическое накопление 18 F-ФДГ в чашечно-лоханочных системах почек. | |
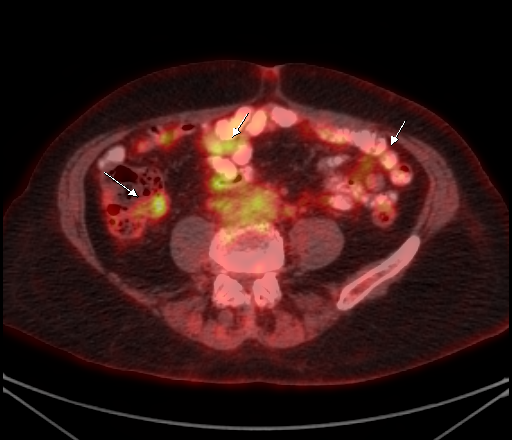 | 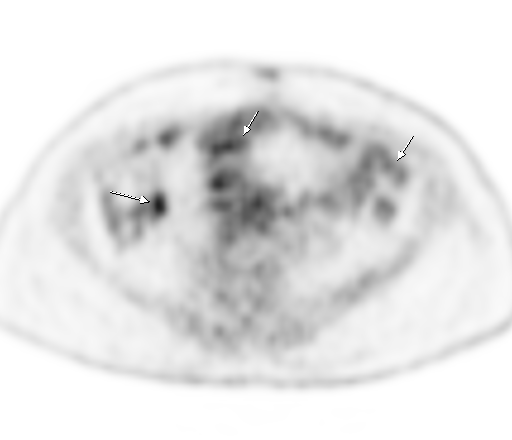 |
| Физиологическое накопление 18 F-ФДГ по ходу петель толстой кишки. | |
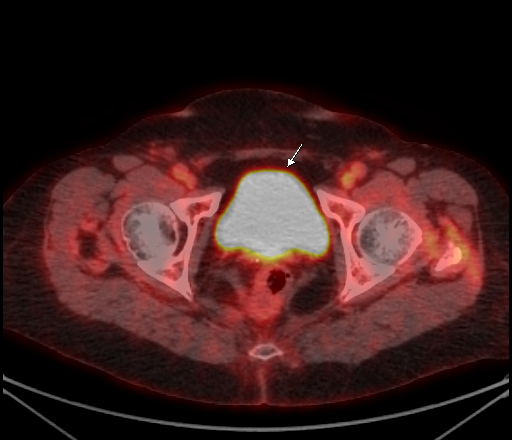 |  |
| Физиологическое накопление 18 F-ФДГ в мочевом пузыре. | |
Вопрос №4. Что такое патологическое накопление РФП?
Патологическое накопление РФП – это повышенное накопление РФП в органах и тканях, регистрирующееся при заболеваниях, чаще всего в злокачественных опухолях.
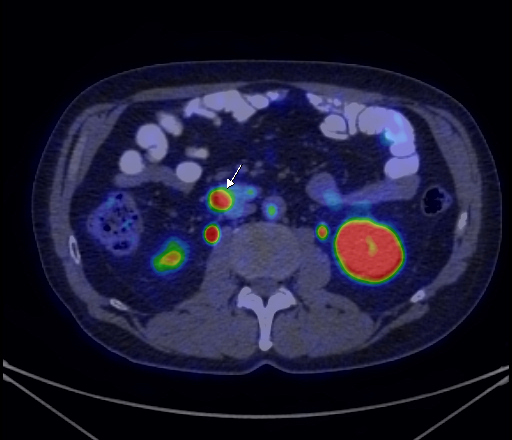 |
| Данные ПЭТ/КТ с 68 Ga-DOTA-TATE у пациента с нейроэндокринной опухолью тощей кишки. В проекции злокачественной опухоли, расположенной в тощей кишке, определяется очаг патологической гиперфиксации РФП. |
 | 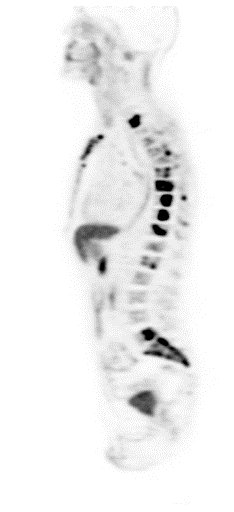 | 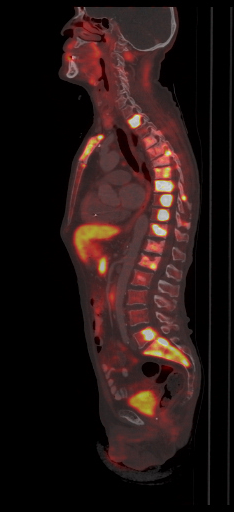 |
| Данные ПЭТ/КТ с 11 С-холином у пациента с раком предстательной железы. Состояние после простатэктомии. В костях скелета визуализируются множественные очаги патологического накопления РФП (метастазы). | ||
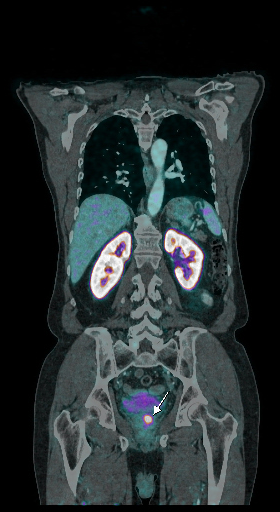 | 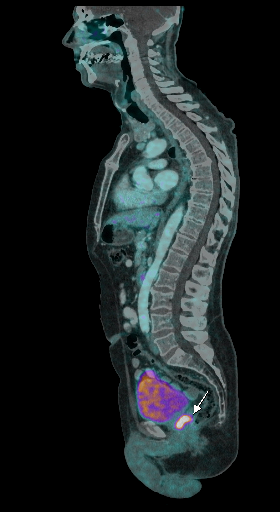 | 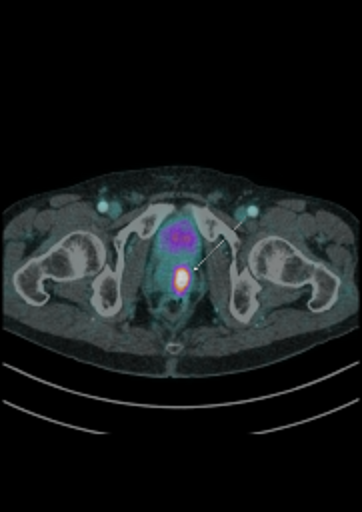 |
| Данные ПЭТ/КТ с 68 Ga-ПСМА у пациента с местным рецидивом рака предстательной железы. Состояние после лучевой терапии. В левых отделах предстательной железы определяется очаг патологического накопления РФП. | ||
Вопрос №5. Что такое метаболически активное и метаболически неактивное образование?
Метаболически неактивное образование – это образование, которое не накопило РФП. Чаще всего отсутствие повышенного накопления РФП в опухоли свидетельствует о ее доброкачественной природе.
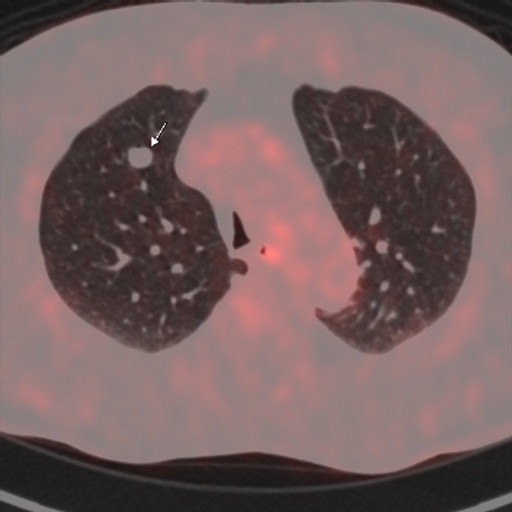 |
| Данные ПЭТ/КТ с 18 F-ФДГ у пациента с метаболически неактивным образованием правого легкого (доброкачественная опухоль — гамартома). |
Метаболически активное образование – это образование, в котором накопился РФП в повышенном количестве. Повышенное накопление РФП в опухоли чаще всего свидетельствует о ее злокачественном характере.
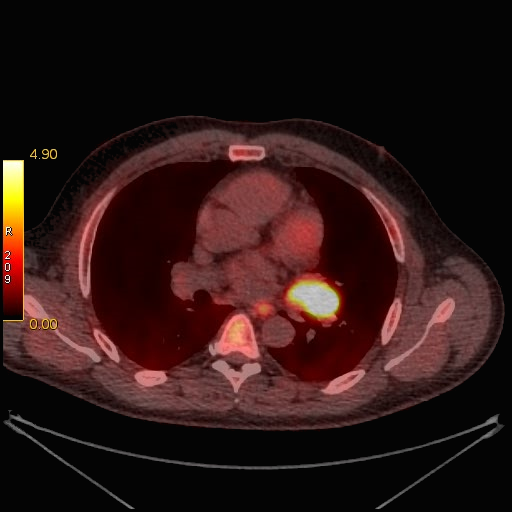 |
| Данные ПЭТ/КТ с 11 С-метионином у больного с метаболически активным образованием корня левого легкого (типичный карциноид). |
Вопрос №6. Что такое SUV?
SUV (Standardized Uptake Value, стандартизированный уровень захвата) – это величина, отражающая интенсивность накопления РФП в зоне интереса, например, в опухоли.
Показатель SUV рассчитывается программным комплексом автоматически и измеряется в различных единицах. В нашем Центре, как и в большинстве отечественных и зарубежных медицинских учреждений, где проводится позитронная эмиссионная томография, в качестве единиц измерения показателя SUV принято использовать г/мл (g/ml).
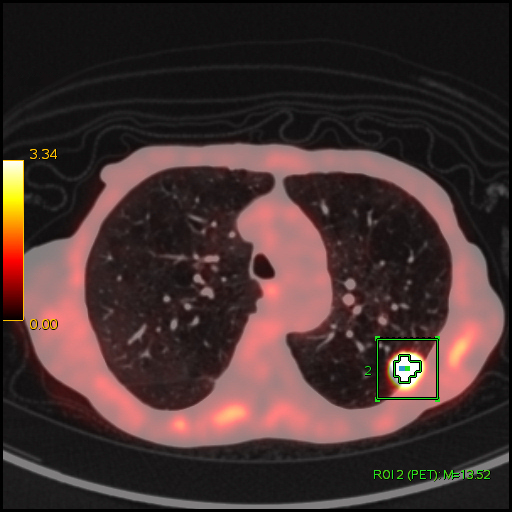 |
| Данные ПЭТ/КТ с 18 F-ФДГ. Оконтуривание метаболически активной злокачественной опухоли левого легкого для измерения показателя SUV. В данном случае величина SUV в опухоли определяется на уровне 13,52 g/ml. |
Вопрос №7. Для чего используется величина SUV?
Величина SUV в основном используется для оценки ответа злокачественной опухоли на проведенное лечение. Важно подчеркнуть, что в ряде клинических ситуаций показатель SUV в опухоли является единственным критерием, позволяющим оперативно получить информацию о чувствительности образования к только что начатой терапии.
Если опухоль чувствительна к лечению, то уровень SUV в ней при повторном ПЭТ-исследовании будет снижаться, если нечувствительна или малочувствительна (резистентна, устойчива) – значение SUV останется без изменений или увеличится. Следует помнить, что своевременная диагностика устойчивости опухоли к лечению позволит скорректировать план лечения, а в некоторых случаях и радикально его изменить.
Как уже было сказано выше, для оценки эффективности терапии врач-радиолог оценивает динамику показателя SUV до и после лечения.
Существует четыре варианта метаболического ответа опухоли на проведенное лечение:
- Частичный метаболический ответ – устанавливается при уменьшении значения SUV в опухоли на 25% и более;
- Полный метаболический ответ – заключается в отсутствии повышенного накопления РФП в опухоли;
- Метаболическое прогрессирование – устанавливается при увеличении SUV на 25% и более и/или при появлении новых очагов патологической гиперфиксации РФП;
- Метаболическая стабилизация – регистрируется при отсутствии достоверных (менее 25%) изменений показателя SUV в опухоли.
 |  |  |
| а | б | в |
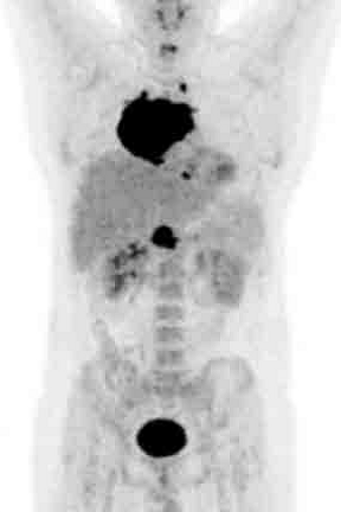
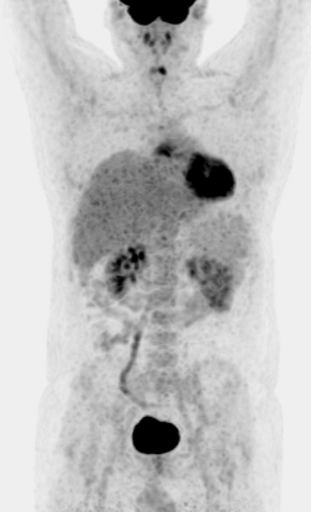
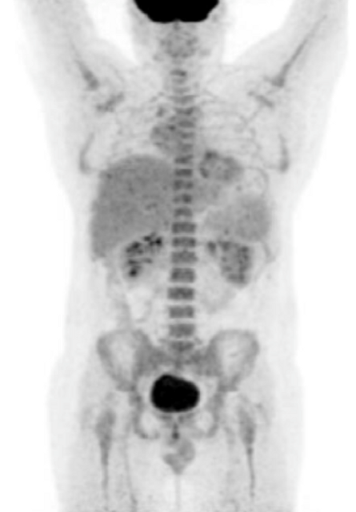
Результаты ПЭТ с 18 F-ФДГ у пациента с диффузной В-клеточной крупноклеточной лимфомой до лечения (а), после 2 курса ПХТ (б) и через 13 месяцев после окончания терапии (в).
а – до лечения в средостении визуализируется массивное метаболически активное образование с уровнем SUV=12,6;
б – после 4 курса ПХТ отмечается значительное уменьшение метаболического объема опухоли и снижение показателя SUV до 3,4 (достигнут частичный метаболический ответ, т.е. опухоль чувствительна к выбранной ПХТ);
в – через 13 месяцев после окончания ПХТ очагов патологической гиперфиксации РФП в проекции органов средостения не обнаружено (достигнут полный метаболический ответ).
Источник
Suv max накопление таблица расшифровки онкология
Реферат. Для уточнения стадии заболевания и выбора адекватной тактики лечения у больных периферическим немелкоклеточным раком легкого необходимо рациональное использование методов лучевой и ядерной диагностики костных метастазов. В работе представлены результаты использования комплекса современных методов лучевой и ядерной диагностики (ОФЭКТ/КТ, ПЭТ/КТ с ФДГ) у 71 пациента с периферическим немелкоклеточным раком легкого с целью выявления костных метастазов. Проведена оценка диагностических возможностей ОФЭКТ/КТ и ПЭТ/КТ с ФДГ.
© А.В. Ларюков, Р.Ш. Хасанов, В.П. Потанин, Е.К. Ларюкова, 2016
А.В. Ларюков, Р.Ш. Хасанов, В.П. Потанин, Е.К. Ларюкова
ГАУЗ «Республиканский клинический онкологический диспансер МЗ РТ», г. Казань
ГБОУ ДПО «Казанская государственная медицинская академия» МЗ РФ, г.Казань
Приволжский филиал ФГБНУ «Российский онкологический научный центр им. Н.Н. Блохина», г. Казань
Ларюков Андрей Викторович ― кандидат медицинских наук, доцент кафедры ультразвуковой диагностики, ассистент кафедры онкологии, радиологии и паллиативной медицины ГБОУ ДПО «Казанская государственная медицинская академия МЗ РФ»; заведующий ОЛД ГАУЗ «Республиканский клинический онкологический диспансер МЗ РТ»
420019, г. Казань, Сибирский тракт, д. 29, тел.: (843) 525-72-32, +7-960-032-42-96, e-mail: Этот адрес электронной почты защищён от спам-ботов. У вас должен быть включен JavaScript для просмотра.
Ключевые слова: однофотонная эмиссионная томография (ОФЭКТ), позитронно-эмиссионная томография (ПЭТ), периферический немелкоклеточный рак легкого (ПНРЛ), метастазы, кости.
Анализируя данные литературы мы отметили разноречивые сведения о диагностических возможностях радионуклидных методов диагностики (ОФЭКТ/КТ и ПЭТ/КТ) в выявлении костных метастазов, о целесообразности их использования в различных клинических ситуациях [1, 2]. Детальных сведений о сопоставлении результатов радионуклидных методов диагностики в выявлении костных метастазов у больных периферическим немелкоклеточным раком легкого мы не встретили.
В то же время, частота метастатического поражения скелета у больных с периферическим раком легкого по данным различных авторов составляет от 15 до 70% [3, 4]. Отмечена возможность бессимптомного течения костных метастазов и возможность их возникновения на ранних стадиях рака легкого [5, 6].
Своевременное выявление костных метастазов оптимизирует отбор больных на хирургическое лечение и улучшает выживаемость [7]. Это необходимо иметь в виду при определении показании к хирургическому лечению рака легкого, которое целесообразно лишь в случае отсутствия отдаленных, в том числе костных метастазов.
Согласно нашим данным вторичное поражение скелета у больных с периферическим немелкоклеточным раком легкого (ПНРЛ) составляет около 50% [8], причем нередко костные метастазы протекают малосимптомно или бессимптомно, и их частота не коррелирует с размером первичной опухоли [8, 9].
В настоящее время существует широкий арсенал методов лучевой и ядерной диагностики, которые с большим или меньшим успехом используются для выявления костных метастазов у онкологических пациентов [4, 10, 11]. Адекватное использование различных диагностических методов, в том числе у потенциально операбельных больных ПНРЛ способствует уточнению стадии заболевания и выбору оптимальной лечебной тактики.
Стоит отметить отсутствие единой точки зрения на целесообразность и последовательность использования современных методов лучевой и ядерной диагностики, таких как позитронно-эмиссионная томография с ФДГ, совмещенная с рентгеновской компьютерной томографией (ПЭТ/КТ), и однофотонной эмиссионной компьютерной томографии, совмещенной с рентгеновской компьютерной томографией (ОФЭКТ/КТ) с учетом их диагностических возможностей в различных клинических ситуациях и в зависимости от технической оснащенности. Мы предприняли попытку сравнить диагностические возможности ПЭТ/КТ и ОФЭКТ/КТ в выявлении костных метастазов у больных ПНРЛ и сопоставить их с данными, представленными в литературе.
Цель исследования ― cравнение диагностических возможностей ПЭТ/КТ с ФДГ и ОФЭКТ/КТ в выявлении костных метастазов у больных ПНРЛ.
Методы исследования
ПЭТ/КТ исследования выполнялись на совмещенных диагностических системах Discovery 600 и Discovery 690 (General Electric, США). Использовался протокол «Whole body», включающий последовательное диагностическое КТ-сканирование и позитронно-эмиссионноую томографию. В зону исследования входила область тела от козелка ушных раковин до средней трети бедра. В некоторых случаях при проведении КТ части протокола болюсно вводился рентгеноконтрастный неионный препарат в объеме 100-120 мл. Артериальная фаза контрастного исследования проводилось на глубоком вдохе. ПЭТ сканирование включало 5-6 зон (кроватей) исследования. Анализ полученных данных проводился с учетом просмотра КТ, ПЭТ и совмещенных ПЭТ/КТ изображений. КТ-томограммы оценивались визуально в каждой фазе с использованием мультиплоскостных реконструкций с обязательным измерением размеров очагов и денситометрических показателей по шкале Хаунсфильда. Проводилась визуальная оценка ПЭТ-данных с учетом интенсивности накопления РФП по цветовым шкалам и полуколичественным методом с определением стандартизированного уровня накопления РФП (Standardized Uptake Value, SUV), оценивался SUVmax. Для получения совмещенных ПЭТ/КТ изображений применяли прикладной программный пакет «Fusion». Характеристика патологических очагов включала: локализацию, размеры, соотношение с соседними структурами, наличие и интенсивность гиперфиксации радиофармпрепарата.
ПЭТ-КТ выполнялась с радиофармпрепаратом (РФП) 18F-фтордезоксиглюкозой (18F-ФДГ), который вводился внутривенно в дозе 370-480 МБк. После введения пациенты для накопления 18F-ФДГ в клетках в течение 60-90 мин. находились в максимально расслабленном состоянии. Непосредственно перед исследованием пациенты опорожняли мочевой пузырь. При необходимости для дифференциальной̆ диагностики воспалительного и опухолевого процессов выполнялось отсроченное ПЭТ исследование через 120-180 мин.
ОФЭКТ/КТ с 99Тс-технетрилом проводили на гибридной системе SimbiaТ16 (Siemens, Германия) c 16-срезовой конфигурацией КТ. Получение сцинтиграфического изображения всего тела проводилось в режиме «Whole Body».
Исследование проводилось в положении лежа на спине с использованием коллиматоров высоких энергий (HEGP). Продолжительность однофотонной эмиссионной компьютерной томографии (ОФЭКТ) составляла 10-15 минут. Общая длительность исследования составляла 20-25 минут.
Данные КТ и ОФЭКТ обрабатывались с применением пакета программного обеспечения «Fusion», позволяющего совместить полученные результаты, которые оценивались во фронтальных, сагиттальных и трансаксиальных плоскостях. Оценка КТ-данных проводилась в различных проекциях и с использованием показателей плотности по шкале Хаундсфилда.
Была проведена статистическая обработка полученных результатов с расчетом чувствительности и специфичности для каждого метода в выявлении костных метастазов.
Рис. 1. Сравнительные характеристики ПЭТ/КТ и ОФЭКТ/КТ в выявлении костных метастазов у больных ПНРЛ
Рис. 2. Остеосцинтиграфия больного А. Единичный очаг патологической фиксации РФП в головке правой плечевой кости
Рис. 3. РКТ больного А.: субкортикально в дорсальных отделах головки правой плечевой кости определяется участок неравномерной деструкции с наличием в данной области краевых разрастаний, несколько деформирующих контур головки
Рис. 4а, б. ПЭТ/КТ больного А. В S2 правого легкого очаг гиперфиксации ФДГ (SUVmax=6,5), соответственно бугристому объемному образованию 46х44 мм с лучистыми контурами. Метаболически активных увеличенных средостенных узлов не определяется. Определяются очаги патологической фиксации ФДГ (SUVmax=5,6), соответственно краевому участку деструкции костной ткани 15 мм в головке правой плечевой кости, очагу деструкции 3 мм в остистом отростке L5, очагу деструкции 3 мм в теле правой подвздошной кости, очагу деструкции 4 мм кортикально в области правой вертлужной впадины
Рис. 5а-в. ПЭТ/КТ больного А.: определяются очаги патологической фиксации ФДГ (SUVmax=5,4), соответственно очагу деструкции 3 мм в остистом отростке L5, очагу деструкции 3 мм в теле правой подвздошной кости, очагу деструкции 4 мм кортикально в области правой вертлужной впадины
Материалы исследования
Проанализированы результаты комплексного обследования 71 больного ПНРЛ. Средний возраст больных составил 62,1±2,4 года, среди них мужчин ― 51 (72%), женщин ― 20 (28%). Первичная опухоль локализовалась в верхней доле у 41 пациента, в нижней доле ― у 30 пациентов. По размеру первичного очага (констриктор «T») пациенты распределились следующим образом: с Т1 — 5 человек, с Т2 — 49 человек, с Т3 — 12, с размером первичного очага Т4 — 5 человек.
По гистологической структуре первичного очага пациенты распределились следующим образом: плоскоклеточный рак — 17 пациентов, аденокарцинома — 41 пациент, крупноклеточный рак ― у 2-х пациентов, низкодифференцированный рак — у 10 пациентов и железисто-плоскоклеточный рак ― у 1 пациента.
Результаты исследования и их обсуждение
На основании использования методов лучевой и ядерной диагностики костные метастазы были выявлены у 30 (42,2%) больных ПНРЛ.
У этих пациентов результаты ОФЭКТ/КТ были сопоставлены с результатами ПЭТ/КТ.
При проведении ОФЭКТ/КТ оценивалась вероятность метастатического поражения костей, учитывая наличие участков повышенного накопления РФП («горячие очаги»). Процент накопления РФП в очаге вычисляли, проводя сравнение с симметричным участком нормальной костной ткани, по соотношению очаг/фон. Когда этот показатель превышал 15% ― результат расценивался как положительный. При соотношении очаг/фон от 115 до 125% ― оценивали как накопление невысокой интенсивности, от 125 до 160% ― средней интенсивности, и если превышала 160% ― высокой интенсивности.
При анализе данных ОФЭКТ/КТ участки накопления РФП средней и высокой интенсивности сопоставляли с данными РКТ для уточнения структурных изменений костной ткани и их локализации.
Оценка и анализ результатов ПЭТ с 18F-ФДГ основывался на выявлении очагов повышенного захвата радиофармпрепарата. В основе захвата 18F-ФДГ опухолевой тканью лежит усиленный гликолиз (по сравнению с интактной тканью), обусловленный увеличением числа переносчиков глюкозы в клеточной мембране и активностью ферментов гликолитического распада [12, 13].
С целью математической оценки захвата и выведения 18F-ФДГ в метастатических очагах оценивался стандартизованный уровень захвата РФП (SUV), который является полуколичественным показателем (отношение удельной радиоактивности в зоне интереса к удельной введенной радиоактивности). Расчет производится автоматически с использованием программного комплекса.
При необходимости проводили отсроченные исследования через 50-90 минут после первичного сканирования, где оценивалось увеличение значения уровня стандартизованного захвата РФП в опухолевых клетках при отсроченном сканировании по сравнению с первым сканированием.
Экспозиция при проведении ПЭТ/КТ и ОФЭКТ/КТ не превышала 7 дней.
Были детально проанализированы результаты обследования 30 больных ПНРЛ с метастатическим поражением костей.
У большинства пациентов (21 больной (70%) были выявлены множественные метастазы, локализующихся в нескольких отделах скелета. У 9 (30%) больных были выявлены одиночные метастазы в кости.
Для детального анализа было выделено 8 анатомических отделов скелета, в которых было выявлено метастатическое поражение: шейный отдел позвоночника, грудной отдел позвоночника, поясничный отдел позвоночника, кости таза, проксимальные отделы бедренных костей, проксимальные отделы плечевых костей, ключицы и лопатки, ребра и грудина. Кости черепа и дистальные отделы костей верхних и нижних конечностей были исключены из анализируемых данных в связи с отсутствием метастатического поражения указанных зон.
У 30 больных ПНРЛ с метастатическим поражением костей было проанализировано состояние 240 анатомических отделов скелета.
Было выявлено поражение 78 анатомических отделов скелета.
Преобладало метастатическое поражение позвоночника — 34 случая (43,6%). У 2 (2,56%) больных было выявлено поражение шейного отдела позвоночника, у 13 (16,66%) больных ― поражение грудного отдела, у 19 (24,36%) ― поясничного отдела позвоночника. Поражение костей таза было выявлено у 16 (20,51%) больных, поражение ребер и грудины ― у 15 (19,23%) больных, поражение лопатки и ключицы — у 8 (10,26%) больных, проксимальных отделов плечевых костей ― у 2-х (2,56%) больных и поражение проксимальных отделов бедренных костей ― у 3-х (3,86%) больных.
У 30 пациентов с выявленными костными метастазами были сопоставлены данные ОФЭКТ/КТ и ПЭТ/КТ.
При ПЭТ/КТ было выявлено поражение 77 (98,7%) анатомических областей. В 1 (1,3%) случае по данным ПЭТ был получен ложноотрицательный результат, обусловленный выявленным впоследствии единичным склеротическим очагом в лонной кости размером 7 мм. Однако по данным ОФЭКТ/КТ у данного пациента было отмечено повышенное накопление радиофармпрепарата, соответственно небольшому очагу склероза в лонной кости. При повторном анализе ПЭТ/КТ исследования обратил на себя внимание участок склероза с невысоким уровнем захвата РФП (SUV=2,2), который при первичном анализе не был расценен, как очаг вторичного поражения. Однако следует отметить, что у данного пациента при ПЭТ/КТ и ОФЭКТ/КТ было также выявлено поражение ребра смешанного характера. А при динамическом наблюдении (через 3 месяца) было отмечено незначительное увеличение размеров очага в лонной кости, повышение значений SUV до 4,4, а изменения костной структуры носили смешанный характер с наличием как склеротического, так и невыраженного литического компонента. Ложноположительных результатов ПЭТ/КТ в данной группе обследованных пациентов выявлено не было.
При проведении ОФЭКТ/КТ было верно выявлено метастатическое поражение 71 (91%) анатомической области скелета. Ложноотрицательные результаты были получены в 7 (9%) случаях. В 3-х случаях ложноотрицательные данные были связаны с наличием литических очагов размером менее 5 мм, локализовавшихся в теле С5 позвонка, остистом отростке L5 и в теле подвздошной кости в непосредственной близости к вертлужной впадине. В 4-х случаях ложноотрицательные результаты были обусловлены наличием литических очагов, которые локализовались в лопатке, теле Th12, крестце и лонной кости.
Ложноположительные результаты ОФЭКТ/КТ были получены в 18 (7,5%) случаях при оценке 240 анатомических областей скелета. Очаги повышенного накопления РФП невысокой и средней интенсивности, в этих случаях, преимущественно соответствовали зонам неравномерного склероза с наличием формирующихся участков кистовидной перестройки костной структуры в субхондральных отделах тел и суставных отростков позвонков, субхондральных отделах головки плечевой кости и в теле подвздошной кости, и расценивались как подозрительные на наличие метастатического поражения. А при динамическом наблюдении, и повторном анализе результатов исследования выявленные изменения были расценены как дегенеративно-дистрофические. При сопоставлении с данными ПЭТ/КТ в указанных анатомических зонах не было выявлено очагов повышенной метаболической активности, а также при последующих исследованиях не было выявлено отрицательной динамики изменений (рис. 1).
На основании данных комплексного обследования пациентов ПНРЛ чувствительность ПЭТ/КТ с ФДГ в выявлении костных метастазов составила 98,7%, специфичность метода составила 100%, диагностическая точность метода составила 99,6%.
Чувствительность ОФЭТ/КТ в выявлении костных метастазов ПНРЛ составила 91%, специфичность метода составила 88,9%, диагностическая точность метода ― 87%.
Мы сопоставили нашу оценку диагностической значимости ПЭТ/КТ и ОФЭКТ/КТ с неоднозначными данными литературы, согласно которым чувствительность ПЭТ в выявлении костных метастазов варьирует от 88 до 100%, а специфичность ― от 88 до 98% 14. Данные о чувствительности ОФЭКТ также неоднозначны, и находятся в диапазоне от 82 до 89%, специфичности ― от 73 до 82% [17, 15].
Большой разброс показателей чувствительности и специфичности по данным литературы мы связываем с неоднородным подбором пациентов и использованием в исследованиях как изолированных радиоизотопных методов, так и комбинированных методик.
В качестве иллюстрации приводим наблюдение пациента А. с аденокарциномой верхней доли правого легкого (69 лет).
ОФЭКТ/КТ: Определяется единичный очаг патологической фиксации РФП в головке правой плечевой кости. Соответственно очагу, субкортикально в дорсальных отделах головки правой плечевой кости определяется участок неравномерной деструкции с наличием в данной области краевых разрастаний, несколько деформирующих контур головки (рис. 2).
ПЭТ/КТ: В S2 правого легкого очаг гиперфиксации ФДГ (SUVmax=6,5), соответственно бугристому объемному образованию 46х44 мм с лучистыми контурами. Метаболически активных увеличенных средостенных узлов не определяется.
Определяются очаги патологической фиксации ФДГ (SUVmax=5,6), соответственно краевому участку деструкции костной ткани 15 мм в головке правой плечевой кости (рис. 3), очагу деструкции 3 мм в остистом отростке L5, очагу деструкции 3 мм в теле правой подвздошной кости, очагу деструкции 4 мм кортикально в области правой вертлужной впадины (рис. 4а, б; рис. 5а-в).
Определяется гиподенсное очаговое образование 5 мм в теле левого надпочечника с гиперфиксацией ФДГ (SUVmax=3,0).
Заключение ПЭТ/КТ: Периферический рак верхней доли правого легкого с множественными Мтс в кости, правый надпочечник.
Заключительный диагноз: Периферический рак (аденокарцинома) верхней доли правого легкого T3N0M1. Множественные метастазы в кости: головку правой плечевой кости, остистый отросток L5, тело правой подвздошной кости, левый надпочечник.
Использование комплекса методов лучевой и ядерной диагностики позволило уточнить распространенность и стадию опухолевого процесса и выбрать адекватную тактику лечения.
На основании данных ПЭТ/КТ удалось дополнительно выявить небольшие очаги деструкции в остистом отростке L5 (3 мм), в теле правой подвздошной кости (3 мм), в области правой вертлужной впадины (4 мм), не визуализируемые при ОФЭКТ, и практически не дифференцируемые при нативной РКТ. А также выявлено метастатическое поражение левого надпочечника у одного пациента.
Заключение
По нашим данным ПЭТ/КТ с ФДГ обладает высокой диагностической ценностью в диагностике костных метастазов периферического немелкоклеточного рака легкого. Чувствительность ПЭТ/КТ с ФДГ в выявлении костных метастазов ПНРЛ, специфичность и диагностическая точность метода составили соответственно 98,7, 99,9 и 99,6%.
Чувствительность, специфичность и точность ОФЭТ/КТ в выявлении костных метастазов ПНРЛ составила 91, 88,9 и 87% соответственно.
Дальнейшие исследования позволят уточнить место методов лучевой и ядерной диагностики в алгоритме обследования больных ПНРЛ с целью выявления костных метастазов.
Литература
- Давыдов М.И., Аксель Е.М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2006 г. // Вестник российского онкологического научного центра им. Н.Н. Блохина РАМН. ― 2008. ― Т. 19. ― С. 52-57.
- Ларюков А.В., Ларюкова Е.К. Лучевые методы диагностики в оценке распространенности периферического немелкоклеточного рака легкого // Казанский медицинский журнал. ― 2015. ― Т. 96, №1. ― С. 16-21.
- Лепехин И.В. Результаты совмещенной позитронно-эмиссионной и компьютерной томографии в диагностике и стадировании рака легкого: автореф. дис. . канд. мед. наук. ― СПб, 2011. ― 24 с.
- Сергеев Н.И., Фомин Д.К., Котляров П.М. с соавт. Сравнительное исследование возможностей остеосцинтиграфии и магнитно-резонансной томографии всего тела в диагностике костных метастазов // Медицинская визуализация. ― 2014. ― №4. ― С. 107-113.
- Соколова В.А. МРТ в диагностике и мониторинге метастатических опухолей позвоночника после лучевой терапии: автореф. дис. . канд. мед. наук. ― М., 2009. ― 24 с.
- Трахтенберг А.Х., Франк Г.Н., Поддубный В.В. Особенности диагностики и лечения крупноклеточного рака легкого // Российский онкологический журнал. ― 2007. ― №3. ― С. 4-8.
- Труфанов Г.Е., Рязанов В.В., Дергунова Н.И. с соавт. Совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ/КТ) в онкологии. ― М., 2007. ― 127 с.
- Шавладзе З.Н., Березовская Т.П., Неледов Д.В. с соавт. Диагностика метастатического поражения скелета у больных раком молочной железы: сравнительная оценка МРТ всего тела и сцинтиграфии скелета // Медицинская визуализация. ― 2008. ― №3. ― С. 105-116.
- Ширяев С.В. Опыт применения и перспективы ПЭТ в онкологии // Лучевая диагностика и интервенционная радиология в клинической онкологии. Европейская школа по онкологии. ― М., 2006. ― С. 24-34.
- Clain C. The role of radiologic screening of lung cancer // Radiol. Clin. North. America. ― 1990. ― №28. ― P. 489-495.
- Helyar V. The added value of multislice SPECT/CT in patients with equivocal bone metastases from carcinoma of the prostate / V. Helyar, H. Mohan, T. Barwick et al. // Eur. J. Nucl. Med. Mol. Imaging. ― 2010. ― 37 (4). ― P. 706-713.
- Pearce T., Philips S., Brown J. et al. Bone metastases from prostate, breast and multiple myeloma: differences in lesion conspicuity at short inversion recovery and diffusion-weighted MRI // Br. J. Radiology. ― 2012. ― №85 (1016). ― P. 1102-1106.
- Phelps M., Cherry S. The changing design of positron imaging systems // Clinical Positron Imaging. ― 1998. ― №1. ― P. 31-45.
- Qu X. A metaanalysis of 18FDG-PET-CT, FDG-PET, MRI and bone scintigraphy for diagnosis of bone metastases in patients with lung cancer / X. Qu, X. Huang, W. Yan et al. // Eur. J. Radiol. ― 2012. ― №81 (5). ― P. 1007-1015.
- Romer W. SPECT/CT ― Technical aspects and optimization possibilities / W. Romer // Radiology. ― 2012. ― 52 (7). ― P. 608-614.
- Shen C., Qui Z., Han T. et al. Perfomance of 18F-Fluoride PET or PET/CT for the detection of bone metastases: A metaanalisis // Clinical Nuclear Medicine. ― 2015. ― Vol. 40, №2. ― P. 103-110.
- Tarynos K., Garcia O., Karr B. et al. A correlation study of bone scanning with clinical and laboratory findings in the staging of of non-small-cell lung cancer // Clin. Nucl. Med. ― 1991. ― №16 (2). ― P. 107-109.
Источник















